CEマークの認証が必要とされる地域
CEマーキングの認証が必要とされる地域は32ヵ国
CEマーキングが必要となる国・地域は、EU(欧州連合)加盟国28ヵ国に加え、欧州経済地域(EEA)を構成するEU(欧州連合)28ヵ国以外のアイスランド、ノルウェー、リヒテンシュタインとEU加盟候補国であるトルコの計32ヵ国が対象です。EFTAの加盟国で唯一、スイスだけは、個別の相互認証協定(MRAs/Mutual recongition agreements)で相互に安全・品質基準を承認しています。
*EU加盟候補国であるトルコはEU(欧州連合)と協調関係にあり、CEマーキング等のEUの法規制に準拠した法律の整備を進めています。
*イギリスはEU離脱によりUKCAマークを採用する予定ですが、2020年末まではCEマークを受入れます。
CEマーキングが必要となる国一覧
アイルランド、イタリア、イギリス、エストニア、オーストリア、オランダ、キプロス、ギリシャ、クロアチア、スウェーデン、スペイン、スロバキア、スロベニア、チェコ、デンマーク、ドイツ、ハンガリー、フィンランド、フランス、ブルガリア、ベルギー、ポーランド、ポルトガル、マルタ、ラトビア、リトアニア、ルーマニア、ルクセンブルク、アイスランド、ノルウェー、リヒテンシュタイン、トルコ、(スイス)
CEマーキングが世界の潮流となる理由
近年、EU(欧州連合)加盟国に限らず、アジアや中東への輸出に対してもCEマーキングを条件とする国や企業が増えています。日本企業の海外進出において、CEマーキングが事実上の必須条件になりつつあります。
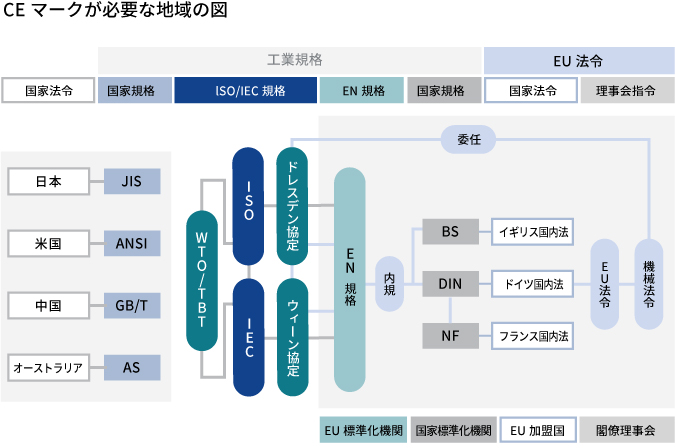
その背景として、ISOやIECなど国際規格が欧州(欧州連合)主導となる世界的な動きがあります。参考までに下の図をご覧ください。
CEマークへの適合が必要とされる製品
ニューアプローチ指令に該当しているかを確認
ニューアプローチ指令によってCEマークの貼付が定められている場合、製品を流通・販売する前にCEマークを貼付することが義務づけられています。製造事業者は必ず、流通・販売しようとする製品がニューアプローチ指令に該当しているかどうか事前に調べる必要があります。
— 製品が市場に投入されたとき、およびエンドユーザーに届く前に利用可能な状態となるとき、EU整合法令が適用される。
— EU整合法令はあらゆる形態の販売に適用される。カタログまたは電子商取引によって提供される製品は、カタログまたはWebサイトがEU市場に提供を指示し、注文および出荷システムを含めた時点で、EU整合法令を満たさなければならない。
— EU整合法令は、新しく製造された製品のみならず、第三国から輸入された使用済みおよび中古製品も、それらが初めてEU市場に入るときに適用される。
— EU整合法令は、最終製品に適用される。
— 元の性能・目的・タイプなどの変更を目的とした重要な変更、またはオーバーホールの対象となった製品は、新しい製品と見なされる場合がある。変更を実行する人は、対応する義務を持つ製造者となる。
つまり、製品は上市された(または使用できる状態)時点で法的要求を満たさなければならない(中古製品も含む)。
CEマーキングにおける「製造者」と法的義務
EU法令での製造者とは?
EU法令における製造者の定義には以下の内容が含まれます。
製造者とは、製品を製造または設計した自然人または法人のこと。もしくは、製造を委託し自身の名称・商標で製品を上市するあらゆる自然人または法人のことを指す。
製造者は、製品の適合性評価に責任を負い、トレーサビィリティー要求を含む一連の義務を負う。
製品を上市する際の製造者の責任は、製造者がEU域外または加盟国内に設立されていても同じである。
製造者は、製品がリスクを引き起こした場合や不適合の場合に市場監視を所管する国家当局に協力しなければならない。
設計/製造工程が製品の適合のために必要な対策項目
製造者における一般原則として、製品を上市するときに製造工程が製品の適合を確実にするために必要な対策事項になります。
- 適合性評価の実施あるいは実施をさせること。そして製品の適合に全責任を負う。
- 技術文書(テクニカルファイル)を作成する。
- EU適合宣言書を作成する。
- 整合法令で要求される取扱説明書、安全情報を消費者、最終使用者が容易にわかる言語で作成し製品に添付する。
- CEマークを製品上に適用法令に従い貼付する。
- シリーズ生産が適合状態になるように手続きを確実にする。製品設計または特性の変更・適合を宣言する整合規格または他の技術仕様の変更は適切に考慮されなければならない。製造者が処置を行う場合は、整合規格または技術仕様の変更の性質、特に、これらの変更が必須要求事項または他の法的要求のカバー範囲に関係するか、当該製品に関係するか否かによる。この場合、例えばEU適合宣言書の更新、製品設計の変更、NB(認証機関)とのコンタクト等が必要になることもある。
- 関係する場合は、製品および品質システム(ISO9001など)の認証を取得する。
CEマーキングにおける「認定代理人」 の法的義務
認定代理人の指名について
製造者は、EU域内に設立されているか否かに関係なく、
製造者に代わっていくつかの業務を実施するEU認定代理人(European Authorized Representative)をEUで指名する事ができます。
製造業者がEUに設立されているかどうかに関係なく、該当するEU整合法令に要求される特定のタスクを遂行する認定代理人を指名することができます。EU域外に設立された製造業者は、認定代理人を有することは義務ではありません。
認定代理人の指名が必須となる場合
しかし、下記のような該当製品・対象指令/規則の場合、認定代理人の指名が必須となります。
大きく2つに分類され、1つ目が医療機器、2つ目が機械です。
医療機器と機械では、認定代理人に対する要求が異なるため、それぞれ解説していきます。
医療機器におけるEU認定代理人
該当規則に適合するために、以下の条件を満たす製造者は、EU認定代理人を任命する必要があります。
・加盟国に登録された事業拠点がない
・以下を製造している製造者である:
1. 欧州体外診断用医療機器
2. 医療機器
3. 能動埋込型医療機器
医療機器指令及びインビトロ診断用医療機器指令によれば、製造者は、加盟国に登録された事業拠点がなく、かつ、自分の名前で機器をEUに上市する場合、医療機器のマーケティングに責任を負うためのEUに設立された者を指名しなければならない。
医療機器における認定代理人の役割
認定代理人の正確な役割と責任は、EU規則内で説明されています。
・ 製造者に代わって行動する
・ 要求に応じて、認定代理人を所管官庁に任命する製造者の委任状の写しを提出する
・ EU適合宣言書およびテクニカルファイルが作成されていることを確認する
・ 該当する場合、適切な適合性評価手順が製造者によって実行されていることを確認する
・ テクニカルファイル、適合宣言書のコピー、および該当する場合は、所管官庁が自由に使用できる関連証明書のコピーを保管する
・ 登録義務を遵守する
・ 製造者の登録義務の遵守を確認する
・ 要求に応じて、デバイスの適合性を実証するために必要な情報と文書を所管官庁に提供する
・ 所管官庁によるサンプルの要求、またはデバイスへのアクセスを製造者に転送し、所管官庁がサンプルを受け取るか、デバイスへのアクセス権が付与されていることを確認する
・ デバイスによってもたらされるリスクを排除する、またはそれが不可能な場合は軽減するために講じられたあらゆる予防的または是正措置について所管官庁に協力する
・ 指定されたデバイスに関連する疑わしいインシデントについて、医療専門家、患者、およびユーザーからの苦情およびレポートについて製造者に通知する
・ 欠陥のあるデバイスについて、製造者と同じ根拠・共同で、また個別に、法的責任を負う
しかし、EU認定代理人の最も重要な務めは、ヨーロッパ市場への容易なアクセスを確保することです。
機械におけるEU認定代理人
続いて、機械におけるEU認定代理人について解説します。機械指令2006/42 / ECは、2009年12月29日に機械指令98/9/ECに取って代わり、
いくつかの重要な変更が行われました。日本企業の製造者にとって最も注目すべきは、ヨーロッパの住所がEC適合宣言書と半完成した機械の組込宣言書に示されなければならないことです。
この法的要件は、機械指令2006/42 / ECのANNEX II、パートAおよびパートBで説明および詳細に説明されています。
この認定代理人の住所は、EU当局が機械のテクニカルファイルを正式に要求するために使用されることを意図しています。
ECの適合宣言書または半完成した機械の組込宣言書は、この住所がないと無効になり、機械のCEマーキングとして不適合であり、違法になります。
この住所は、機械がヨーロッパで使用される日から10年間は有効でなければなりません。ですので、10年間はEU当局から連絡があった際、
この認定代理人にはいつでも速やかな対応が求められます。そのため、ヨーロッパのエンドユーザーまたは販売代理店などをEU連絡先として利用することはお勧めしません。
ヨーロッパ市場に簡単にアクセスできるようにするには、プロセスを案内してくれる適切で正式な認定代理人を選ぶことが重要なのです。
EU認定代理人の代行サービス
リープは、このEU認定代理人の代行サービスをご提供しております。このサービスでは、
EU域内の正式な連絡先として、EU当局がお客様のテクニカルファイルを正式に要求する際の、ヨーロッパの住所を示します。
EU当局からテクニカルファイルの提出要求が行われた際は、製造者にそのことを通知し、要求に応じてテクニカルファイルを当局に提供します。
EU当局からの要求に慌てることなく、コーディネーターが日本語で対応いたします。
詳しい内容は、お問合せフォームよりお気軽にお問い合わせください。
CEマーキングのための「6つのステップ」とは?
製造業者の責任
製造業者は、欧州経済地域(EEA)へ上市された製品の安全性を確保する上で重要な役割を果たします。彼らは、自社製品がEUの安全・健康・環境保護要件を満たしているかどうかを確認する責任があります。適合性評価の実施、技術ファイルの設定、EU適合宣言の発行および製品へのCEマークの貼付は、製造業者の責任です。この義務を果たすことによって初めて、製品をEEA市場へ上市することが可能になります。
「正しい手順」
CEマーキングにも「正しい手順」が存在します。あなたが製造業者である場合、次の6つの手順に従って製品にCEマーキングをする必要があります。
- 製品が適用を受けるすべての「指令/規則」と「整合規格」を特定する。
- 「製品固有の要求事項」を確認し、指令の「必須要求事項」を満たしていることを証明するために用いる「整合規格」や「その他の技術的手段」を選択する。
- 「Notified Body(通知機関)」による第三者評価の必要性を確認する。
- 製品をテストして、製品が「指令/規則に適合しているかどうか」を確認する。
- 製品が適用を受けるすべての「指令/規則」が要求するテクニカルファイル(技術文書)を作成し、それを利用できるようにする。
- 製品にCEマークを貼付し、EC適合宣言書を作成する。
「6つのステップ」は製品により異なる
上記で述べた6つのステップは、製品によって適合性評価手順が異なります。例えば、ガスボイラーなどの安全性のリスクが高い製品は、製造業者だけで安全性をチェックすることはできません。この場合、独立した組織、具体的には国家当局によって任命された「Notified Body(通知機関)」によって、安全性チェックを実行する必要があります。製造業者はこれらの評価を行った後、ようやく製品にCEマークを貼付することができます。
また、CEマークの該当しない製品にCEマークを貼付することはできませんので、ご留意ください。
【参考:
https://ec.europa.eu/growth/single-market/ce-marking/manufacturers_en】
欧州の市場監視システム(RAPEX)とは?
市場流通後の製品/装置を監視する仕組み「RAPEX」
欧州には製品/装置を市場流通後に監視する仕組みが国ごとに設けられております。
それが「RAPEX」です。
RAPEXは通知機関であり、全世界からアクセス可能な違反事例集を掲載しています。ここへ掲載されると二度と取り消されることはなく、ブランドイメージの悪化、欧州市場への上市の制限に繋がります。さらに製品の市場からの回収、利用停止、違反金の対象になる場合もあります。国によっては禁固刑の場合もあるため、絶対に掲載されないよう注意しなければなりません。
違反の発見方法
CEマークの手順/方法さえ間違えなければ、RAPEXに掲載されることはありません。ではどのような場合に、違反が発見されるのでしょうか?
一般消費者用製品での市場監査方法は、市場流通製品の抜き取り、稼働後の工場監査、ユーザーからの通報などが挙げられます。産業機器の場合、抜き取り検査の可能性は低いですが、現場での事故や労働者からの通報による発見が多いです。
RAPEXへの通報は誰でも出来ますので、競合他社からの嫌がらせの可能性もあります。
通報された場合どうなるか?
RAPEXは疑義が生じた場合、製造業者にTCFの一部やDoCの開示を要求してきます。
通報された現地からの連絡ですので、何語で来るかわかりませんのでご注意ください。
開示要求の際に開示までの期間も設けられます。期間は開示要求の原因により異なりますが、人身事故が原因の場合は24時間以内に設定されることもあります。要求に気が付かない、対応できない場合はRAPEXへの掲載に繋がります。
RAPEXへの掲載回避には法律をしっかり守ること
特に産業機械に関しては抜き取り検査の可能性が低いため、安易にCEマークを貼付し輸出されている企業様を多く見かけます。
恐らくリスクと認証費用を天秤にかけ判断されているかと思いますが、CEマークはコンプライアンスの問題ですので、天秤に乗せることはできません。
RAPEX掲載の割合が一般消費者向け製品に偏っているため、今後間もなく産業機械(BtoB製品)を監査する仕組みが出来上がります。
当たり前のことですが、法律をしっかり守れば全く気にしなくてよい制度です。